Priekšdziedzera vēzis (PV) ir viens no biežākajiem ļaundabīgajiem audzējiem vīriešiem. Šobrīd aktuāla problēma ir agrīna priekšdziedzera vēža diagnostika t.i. gadījumi, kad digitāli rektāli prostata neizmainīta,bet aizdomas par malignitāti rada palielināts PSA līmenis asins serumā. Īpaši svarīgi būtu agrīnā prostatas vēža diagnostika agresīva prostatas vēža slimniekiem, jo mirstību no prostatas vēža pārsvarā veido šie vēža gadījumi. Pētījumos pierādīts, ka ar mūsdienu vizualizācijas metodēm ir iespējams uzlabot audzēja lokalizāciju prostatā, kas savukārt ļauj tēmēti veikt biopsiju. Tēmētas prostatas biopsijas iespēja, salīdzinot ar pašreiz pārsvarā veiktajām sistemātiskajām biopsijām var paaugstināt prostatas vēža un iespējams arī agresīva vēža diagnostiku, principiāli mainot izmeklēšanas algoritmus un tādejādi optimizējot individuālu terapijas izvēli katram pacientam .
Ideāla prostatas biospija būtu tāda, kas atbilstu sekojošiem kritērijiem:
- adekvāta prostatas vēža konstatēšana t.i. augsta sensitivitāte,
- precīza negatīvo biopsiju noteikšana, t.i. augsta negatīvā prognostiskā vērtība,
- ierobežota klīniski nenozīmīgo prostatas vēžu noteikšana,
- laba sakritība ar prostatas operācijas patoloģiskās izmeklēšanas rezultātiem.
Agrīna prostatas vēža vizualizācijas metodes
Mūsdienās pamatmetodes prostatas audzēja lokalizācijai ir divas:
- Ultrsonogrāfija ar tās derivātiem
- Multiparametru MRI
Ultrasonoskopija ietver ne tikai klasisko transrektālo sonoskopiju (TRUSS), bet arī tās derivātus (elastogrāfijas, plūsmas sonogrāfijas, k/v izmantošana un histoskenēšanu). No miljons prostatas dziedzera biopsijām, kas veiktas ASV 2003. gadā, 90% gadījumu biopsiju veic ar standarta TRUS [1-4].
Magnētiskā rezonanse tiek izmantota, lietojot standarta sekvences, tomēr labāki rezultāti sasniedzami( obligāti izpildot šādas prasības) lietojot stiprāka magnētiskā lauka iekārtas (3T ) DWI (diffusion weighted imaging – difūzijas uzsvērtos attēlus , dinamisko kontrastēšanu un MR spektroskopiju (difūziju izmantotā attēlveidošana), DCE (dynamic contrast enchancement – (dinamiskais kontrasta pastiprinājums) un spektroskopija [1-4].
Šobrīd dažas no šīm izmeklēšanas metodēm klīniskajā praksē tiek izmantotas reti, dažas biežāk, bet nākotnē tām ir liela perspektīva precīzai un ātrai diagnozes noteikšanai. To izmantošana varēs būtiski samazināt biopsiju skaitu un ar to saistītās komplikācijas, kā arī ļaus izvēlēties precīzāko terapijas metodi konkrētajam pacientam.
Priekšdziedzera transrektāla ultrasonoskopija (TRUS)
TRUS izmeklējumā lieto speciālu 7,5–10 MHz mikrokonveksu, endokavitālu zondi. Pirms šī izmeklējuma nepieciešama sagatavošana: iztukšota taisnā zarna (piemēram, ar klizmas palīdzību), kas īpaši svarīgi, ja ir plānota biopsija. Pacients izmeklējuma laikā guļ uz kreisajiem sāniem, kājas pievilktas pie vēdera. Prostatas apskate notiek divās plaknēs – gareniskajā (sagitālajā) un šķērsgriezuma (transversālajā) un trīs līmeņos – galotne (apekss), vidusdaļa un pamatne (bāze). Atzīmē ehostruktūras viendabīgumu, mezglus, kontūras, izvērtē vaskularizāciju. Tiek izdarīti precīzi prostatas lieluma mērījumi un, izmantojot formulu AP × CC × LL × 0,52 (cm³), noteikts priekšdziedzera tilpums, kas ir svarīgs rādītājs, lai pareizi izvēlētos ārstēšanas metodi. Izvērtē arī sēklas pūslīšus. Ja ir diferenciāldiagnostiskas grūtības, izmeklējumu var papildināt ar speciālu kontrasta US izmeklējumu. Visbeidzot, ja nepieciešams, tiek veikta transrektāla priekšdziedzera biopsija US kontrolē – tikai tā var apstiprināt vai noraidīt vēža diagnozi. [5]
ASV un daudzās Eiropas klīnikās uzskata, ka TRUSS pielīdzināma navigācijai, lai prostatas biopsiju izpildītu pareizi. TRUS pozitīvā prognozes vērtība ir 65%, negatīvā prognozes vērtība ir 54%, specifiskums – 54% un precizitāte – 66% [6].
Ultrasonoskopijas izmeklējums sniedz informāciju par centrālo, perifēro dziedzera daļu un kapsulu. US ar kontrastvielas izmantošanu ļauj uzlabot vizualizāciju un noteikt iespējamo PV izplatību (skat. attēlu). [6]
Trīsdimensiju angiogrāfijas iespējas, izmeklējot priekšdziedzera asinsvadus [6]
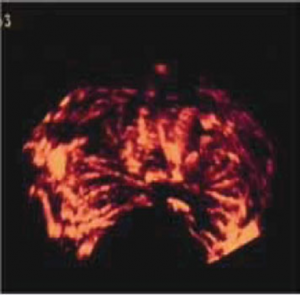
Ehokontrasta ultrasonoskopijas izmeklējums PV gadījumā [6] A. – transverss prostats US attēls pēc i/v kontrastvielas ievades. Kreisā daivā pie dorsālās kontūras pēc kontrastvielas ievades redzams hipervaskularizētu audu apvidus
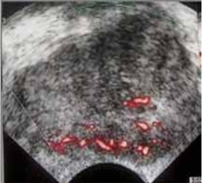
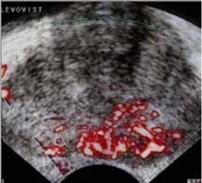
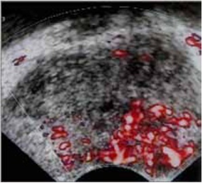
Veicot US, izmantojot kontrastvielas, var noteikt:
- vaskularizācijas simetriju;
- asinsvadu izvietojumu;
- asinsvadu zīmējuma deformācijas zonas;
- dziedzera asinsvadu zīmējuma tipu dažādu slimību gadījumā.
Transrektāla priekšdziedzera biopsija US kontrolē
Klīniskajā praksē priekšdziedzera biopsiju tādā veidā, kā to dara mūsdienās, plaši izmanto pēdējos 10–15 gados, kad parādījās automātiskās ierīces biopsijas veikšanai, kas sastāv no biopsijas pistoles (BIP, Bard, PRO-MAG) un no vienreizējām 16. vai 18. izmēra biopsijas adatām. Biopsiju var iedalīt sistēmiskā (pēc noteikta protokola) un tēmēta (mērķtiecīga biopsija uz malignitāti aizdomīgā rajonā) biopsijā, ko veic transrektālas ultrasonoskopijas kontrolē.
Pēc Jones domām, TRUSS izmeklējumam ir 2 galvenie uzdevumi:
- priekšdziedzera biopsijas procesā nodrošināt audu paraugu pietiekamu garumu no zonām, kas nepieciešams histoloģiska izmeklējuma veikšanai;
- novērtēt prostatas dziedzera tilpumu un formu, atsevišķas tā daļas un sēklas pūslīšus. [7; 8]
Pēdējos 25 gados attieksme pret priekšdziedzera biopsiju nozīmi ir mainījusies. Mūsdienās biopsiju bieži veic, konstatējot palielinātu PSA līmeni asins plazmā pacientiem, kam nav priekšdziedzera izmaiņu pēc DRI datiem. Robertset al [9] 17 gadus analizēja DRI un PSA rādītājus, kas norādīja uz priekšdziedzera biopsijas indikācijām: 1980. gadu vidū priekšdziedzera izmaiņas pēc DRI datiem tika reģistrētas 69% vīriešu, kuriem veica TRUSS un biopsiju, 1990. gadu vidū šīs izmaiņas tika konstatētas 45% vīriešu (tolaik PSA plaši sāka izmantot kā sijājošās atlases marķieri PV diagnostikā). Tajā pašā periodā pacientu skaits ar palielinātu PSA līmeni un bez priekšdziedzera izmaiņām pēc DRI datiem pieauga no 28% līdz 42%.
Mūsdienās priekšdziedzera biopsiju pamatā veic ar transrektālu pieeju. Ir virkne zinātnisku pētījumu, kur atzīmēta augstāka šīs biopsijas metodes diagnostiskā vērtība nekā biopsijai pirksta kontrolē vai biopsijai ar transperineālo pieeju.[10; 11]
Priekšdziedzera biopsija pirksta kontrolē attaisnojama:
- pie nelielas palpējamās punkcijas zonas,kas vizuāli nav redzama TRUSS;
- ļoti augsta PSA līmeņa un liela skriemšļveida prostatas blīvuma gadījumā, kad nav šaubu par PV; šādos gadījumos pietiek ar 2–4 audu paraugiem.
Transperineāla prostatas biopsija rekomendēta taisnās zarnas stenozes, rezekcijas vai taisnās zarnas amputācijas gadījumā, kad nav iespējams ievadīt ultraskaņas zondi vai pirkstu. [12; 13]
Šīs kategorijas pacientiem reti izmanto transgluteālo biopsiju DT kontrolē.[14]
Kopš 2005. gada pakāpeniski pieaudzis publikāciju skaits par atkārtotu priekšdziedzera biopsiju ar transperineālo pieeju, izmantojot stabilizējošas ierīces – brahiterapijas un krioterapijas adapterus. [15; 16]
Prostatas dziedzera transrektālās biopsijas veikšanas indikācijas:
- Paaugstināts PSA līmenis asins plazmā.
- Uz malignitāti aizdomīgi mezgli priekšdziedzerī, izmeklējot digitāli rektāli.
- Transrektālā priekšdziedzera ultrasonoskopijā (TRUSS) vizualizēti hipoehogēni priekšdziedzera audu rajoni.
- Visu šo faktoru kopums. [17]
Ideālai biopsijai vajadzētu atklāt agresīvu PV, pat ja tā tilpums ir mazs. Mūsdienās par “zelta standartu” uzskata izvērsto biopsiju (10 punktu biopsija), daudzi autori iesaka pat piesātinājuma (saturācijas) biopsiju, par kuru lemj pēc pacienta vecuma un priekšdziedzera tilpuma. [18]
Kad veicama piesātinājuma biopsija? Visbiežāk to veic atkārtotas biopsijas laikā pacientiem ar aizdomām par agresīvu PV formu, augstas riska pakāpes vēža diagnostikā un pacientu aktīvas novērošanas programmas sākumposmā.
Kawakami et al[20] runā par to, ka ideāli kombinēt transrektālo un transperineālo pieeju biopsijas veikšanai ne tikai PV diagnosticēšanai, bet arī gadījumos, kad nosaka augstas riska pakāpes vēzi.
Ir arī t.s. “matrices” biopsija, kad paņem pat 50 bioptātus. Tas nav pieņemami, jo to var uzskatīt par līdzvērtīgu tūlītējai transrektālas prostatektomijas veikšanai.[19]
Datorasistētā ultrasonoskopija – histoskenēšana
Tā ir pavisam jauna tehnoloģija, kas apvieno klasisko ultraskaņas attēlu, ko iegūst pelēkās skalas režīmā saiknē ar ultraskaņas aparātu. Prostatas histoskenēšanas (PHS) metodes pamatā ir 12 000 patomorfoloģiskie (histoloģiski apstiprinātas malignitātes, LPH, prostatīta) un ultraskaņas izmeklējumu rezultāti. Šie dati, kas iegūti dažādās Eiropas klīnikās devuši unikālu materiālu elektroniskai datu apstrādei. Procedūra ir saņēmusi atbilstību Eiropas standartiem un, piemēram, Vācijā izmanto ap 40 klīnikās. Tā ir perspektīva tehnoloģija, kuras iespējas vēl nav pilnībā izzinātas, bet jau tagad dod praktisku uzlabojumu prostatas biopsijas plānošanas procesā.[6]
Histoskenēšana veidota, lai verificētu uz malignitāti aizdomīgus rajonus prostatā un veiktu vienlaicīgu vai atliktu biopsiju. Sistēma analizē datus, kas iegūti no ultraskaņas skenera, kurš parāda iespējamo audzēja skarto vietu, formu un tilpumu prostatā. Galvenā sistēmas funkcija ir atšķirt labdabīgos audus no ļaundabīgajiem. [20]
Histoskenēšanas darbības princips
Histoskenēšanas algoritms izstrādāts pēc pilndatu ehosignālu korelācijas analīzes ar patohistoloģisko izmeklējumu rezultātiem pēc radikālas prostatektomijas (RPE).Skaņas viļņu un audu savstarpējā mijiedarbība izraisa fizisko vielu izmaiņas atstarotajā signālā. Ļaundabīgā audzējā ir izmainītas tādas audu īpašības kā blīvums, elastība un tekstūra, kas parādās kā signāla izmaiņas. Standarta B režīmā signāls (pēc būtības radiofrekvences) iziet daudzpakāpju apstrādi, lai noformētu attēlu pelēkās skalas gradācijā. Histoskenēšanā izmantotais pilndatu /neapstrādātais signāls dod vairāk informācijas, kuras nozīmīga daļa standarta sonoskopijas laikā tiek filtrēta, sagrozīta vai izmainīta attēla apstrādes laikā. Histoskenēšanas sistēma izmanto atstaroto ( back scattering) pilndatu augstas frekvences signālu, kam gan ļaundabīgiem, gan neizmainītiem audiem ir daudzi parametri, kas tiek statistiski apstrādāti.
Šo raksturojumu analīzei metodes autori izmanto trīs speciāli izstrādātus statistikas modeļus jeb “audu īpašību algoritmus”, kas arī ir histoskenēšanas sistēmas pamatā. Šos algoritmus var izmantot“interešu zonā” – visā priekšdziedzera tilpumā,un pat neliels apjoms, tikai 0,04 cm3 var radīt aizdomas par malignitāti [21]. Blakus novietoto “vēža pozitīvo” rajonu summa palīdz precīzi novērtēt ļaundabīgā procesa rajona tilpumu, parādīt tā formu un izvietojumu dziedzerī. Šis algoritma komplekts izstrādāts pēc sīkas un rūpīgasdaudzu histoloģisko preparātu “griezumu” analīzes pēc radikālas prostatektomijas un to salīdzināšanas ar pilndatu ehosignāla audu īpašībām (skat. attēlu).
Histoskenēšanas algoritma izstrāde: transrektālās ultrasonoskopijas izmeklējums (pirms radikālas prostatektomijas) (A) un priekšdziedzera kartēšana pēc operācijas (B un C)
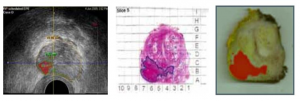
Izmeklējuma procesā pacients atrodas uz kreisajiem sāniem; transrektālās ultrasonoskopijas zonde aprīkota ar motorizētu papildu ierīci, tāpēc iespējama prostatas vienlaicīga skenēšana šķērsgriezuma un frontālajā plaknē un prostatas 3-dimensiju attēla iegūšana.
Pilndatu radiofrekvences signāls no skenera nokļūst datorā, kas pēc“audu īpašību algoritma” analizē iegūtos datus. Sistēma rezultātus sniedz grafiskā veidā uz rekonstruēta trīsdimensiju orgāna modeļa, iekrāsojot zonas, kas aizdomīgas uz PV.
Pirmajiem klīniskajiem pētījumiem PV atklāšanā ar histoskenēšanu ir metodoloģiski trūkumi, tāpat arī neliels pacientu skaits. Lai apstiprinātu metodes efektivitāti būtu nepieciešami kontrolēti daudzcentru pētījumi pēc vienotas un standartizētas metodes. Šī ir salīdzinoši nedārga, neinvazīva metode ar potenciālu uzlabot agrīna agresīva priekšdziedzera vēžadiagnostiku un biopsijas efektivitāti.
Nepatiesi negatīvo rezultātu biežums ar standarta TRUSS biopsiju ir 20–30%. TRUSS biopsijā bieži paliek nediagnosticēti priekšējās un apikālās daļas daļas prostatas audzēji. Izmantojot orgāna trīsdimensiju modeli, var izplānot biopsijas veikšanas vietas no konkrētiem aizdomīgiem rajoniem, samazināt tās invazivitāti, optimizējot biopsiju kopējoskaitu, mazināt komplikāciju skaitu, palielināt histoloģisko izmeklējumu pozitīvos rezultātus. Cits svarīgs aspekts histoskenēšanas izmantošanā ir orgānus saudzējošu metožu (staru terapijas, brahiterapijas, augstu intensīvās fokusētās ultraskaņas, krioablācijas, fotodinamiskās terapijasvai radiofrekvences ablācijas) plānošana. [20]
Sonoelastogrāfija
Amerikāņu pētnieki uzsver prioritāro PV ultraskaņas diagnostikas nozīmi. Metodes pamatā ir ne tikai ultrasonoskopisks PV raksturojums, bet arī audu elastības noteikšana[6].
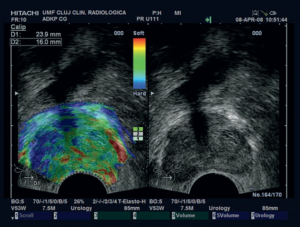
Ir zināms, ka malignās šūnas izvietojas ļoti blīvi, audzēja elastība būtiski samazinās. To arī nosaka urologs izmeklējumā. “Akmens” veida blīvums liecina par izplatītu procesu. Agrās stadijāsnpalpatori noteikt dziedzera sabiezējumunav iespējams. Ultraskaņas aparāts ar elastogrāfijas funkciju, paralēli iegūstot attēlu pelēkās skalas režīmā, ļauj īstenot krāsainu zonu kartēšanu ar atšķirīgu elastību: parastie audi krāsojas zaļā krāsā, bet uz neoprocesu aizdomīgi audi – zilā krāsā (skat. attēlu). Ar endoskopisko zondi var noteikt audzēja invāziju prostatas kapsulā. Sonoelastogrāfija kombinācijā ar klasisko pelēkās skalas ultrasonoskopiju sensitivitāti palielina līdz 89,5% , neatkarīgi no PSA. Specifitāte svārstās no 85 līdz 93%. Lielāka tilpuma priekšdziedzerim sonoelastogrāfijas sensitivitātei ir tendence samazināties. [6; 22]
| Tipiska prostatas vēža (karcinomas) sonoelastogrāfija: asimetriska labā daiva, vairāk nekā 1 cm izmainīti prostatas audi, kais aizdomīgi uz malignitāti katrā dimensijā[19]
|
Magnētiskā rezonanses tomogrāfija (MRT) MR un US
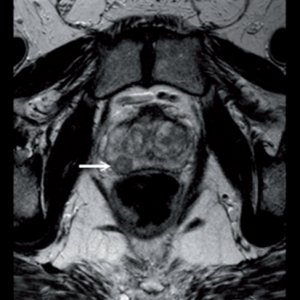
Magnētiskās rezonanses metode dod iespēju iegūt orgānu attēlu vairākās plaknēs. Tas nodrošina lielisku kontrastu starp normāliem un patoloģiskiem audiem. Procedūra nav saistīta ar radiāciju, tā ir neinvazīva, nerada blakus iedarbību. MRT šobrīd tiek uzskatīta par vienu no pamata PV diagnostikas metodēm. T1 un T2 uzsvērtos attēlos jeb t.s. anatomiskos attēlos labi redzami PV audzēja fokusi. Difūzijas uzsvērto attēlu pielietojums, nosakot difūzijas koeficientu, sniedz papildus iespējas malignu audu diferencēšanai no labdabīgām pārmaiņām, Malignu pārmaiņu gadījumā difūzijas koeficients ir zemāks, to nosaka audzēja šūnu lielais blīvums, kura dēļ ūdens molekulu difūzija patoloģisko izmaiņu zonā ir ierobežota. (skat. attēlu). [6; 22]
| MR izmeklējums. T2 uzsvērtā attēlā aksiālā plaknē redzams priekšdziedzera vēzis labās puses perifērajā zonā [22]
|
US un MR ir metodes, kas labi viena otru papildina. Mūsdienās arvien biežāk ziņo par apjomīgu ( volumetrisku) skenēšanu un daudzdimensiju attēlu rekonstrukciju. Vienlaicīga MRT un US izmantošana rada jaunas tehnoloģijas t.s. fusion tehnikas, kas ļauj savienot abu metožu „plusus”.
Magnētiskās rezonanses tomogrāfija ar dinamisko kontrastēšanu
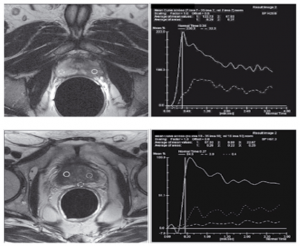
Metode ļauj noteikt maligno šūnu rajonus pēc kontrastvielas uzkrāšanās ātruma un izskalošanās līknes. Audzēja spēcīgās vaskularizācijas un neoangioģenēzes dēļ vēzim raksturīga ātra intensīva kontrastvielas uzkrāšanās. Normāli paramagnētiķa uzkrāšanās notiek 60 sekundēs. PV gadījumā šis rādītājs samazinās līdz 20–30 sekundēm. Maligniem audiem raksturīga arī strauja kontrastvielas eliminācija.T2 sekvenču pielietojums kombinācijā ar dinamisko kontrastēšanu, paaugstina MR izmeklējumu sensitivitāti un specifiskumu atbilstoši līdz 78% un 80%. [6; 19; 22]
Magnētiskās rezonanses spektroskopija
Ir zināms, ka malignās šūnās ir ļoti niecīgs citrāta metabolisms, bet irdaudz holīna un kreatīna. Tāpēc, nosakot holīna un kreatīna daudzuma attiecību pret citrātu daudzumu aizdomīgo izmaiņu zonā, var uzlabot vēža diagnosticēšanu (skat. attēlu). [6; 22]
| PV MR spektroskopijas piemērs.
|
Biopsija magnētiskās rezonanses kontrolē
MR kontrolētai biopsijai ir daudzi “par” un “pret”. Sarežģītības un izmaksu dēļ šādu izmeklējumu nav iespējams veikt visiem pacientiem. Viens no metodes trūkumiem – pacients procedūras laikā it nemaz nedrīkst kustēties, var traucētpat elpošanas kustības, tādējādi mainot rezultātu. Šobrīd biopsija MR kontrolē ir metode, kuras izmantojums ikdienā līdz galam vēl nav izpētīts.[19] un pamazām to aizvieto fusion tehnoloģijas.
Noslēgums
Prostatas vēža standarta izmeklēšanas metode ir biopsija TRUSS kontrolē. Neskatoties uz to, ka speciālisti mēģina palielināt tās efektivitāti, tomēr paliek daudzi sarežģījumi: bieži viltus negatīvi rezultāti, nepietiekoša informācija audu gabaliņu zems reprezentācijas līmenis. Biopsija rada ne tikai diskomfortu pacientam, bet arī komplikācijas, turklāt nav pietiekami precīza, lai pēc biopsijas rezultāta varētu nomierināt pacientu, ka viņam nav klīniski nozīmīgs PV. Ir daudz neinvazīvu PV diagnostikas metožu, bet šobrīd neviena no tām (MR, elastogrāfija, histoskenēšana, tāpat jauno marķieru parādīšanās, ko nosaka asinīs vai urīnā) vēl neaizvieto biopsiju TRUSS kontrolē. Kaut gan, jādomā, ka sistēmisko prostatas biospiju periods ir tuvu beigām un sākas tēmēto prostatas biopsiju laiks.
PV diagnostikas nozīme medicīnas sabiedrībā līdz galam vēl nav saprasta. Šobrīd nav PV diagnostikas vienīgās efektīvās metodes, dažādas metodes izmanto dažādos posmos – pirmreizējai vai apstiprinošai diagnostikai. Tomēr metodes izvēle vienmēr ir kompromiss, bet vislabākais rezultāts ir metožu apvienojumam, ar kuru palīdzību iespējams samazināt biopsiju skaitu, tādējādi izvairoties no biopsijas komplikācijām, izvēlēties katram pacientam individuāli piemērotāko terapiju, rūpīgāk atlasīt pacientus, kuriem noderīgāka ir PV agresīva terapija, kuriem mazinvazīva orgānus saudzējoša metode.[19]
Perspektīvi ir izveidot starpdisciplīnu darba grupu, lai izpētītu jaunās tehnoloģijas un to ieviešanu klīniskajā praksē,metodoloģiski pareizi organizēt sijājošo atlasi, izmantot mūsdienīgākās ultraskaņas metodes (elastogrāfiju, histoskenēšanu), tāpat arī MR inovatīvo tehnoloģiju iespējas, kuru ieviešanai klīniskajā praksē ir vajadzīgs laiks.[6]
Comments are closed.